与罗马 EMBL 显微镜部负责人 Alvaro Crevenna 博士合作
由于空间生物学技术能够同时进行蛋白质组学和转录组学分析,该技术正在迅速发展,成为深入了解组织的强大工具。这些技术的主要目标是通过研究单个细胞来创建大型复杂组织的完整图谱,拥有许多创新功能,在一定程度上改变了传统规则。空间信息的重建正在逐渐改变解决神经生物学、发育生物学和癌症生物学等领域中尚未解决的挑战的方式。
空间分辨率的转录组学研究可以通过显微镜进行,例如原位测序或多重荧光原位杂交。对组织内不同 RNA 种类的分析可以帮助我们了解细胞的异质性、定义细胞类型,并为这种空间信息提供生理背景。
由于空间转录组学涉及高通量、大规模扫描样品,因此必须进行复杂的多维采集,包括大面积拼接、Z 堆栈和多通道成像。
为了支持这种复杂的采集,需要一个能够在短时间内完整地采集样品的装置,而不必降低图像的分辨率。大视场 (FOV) 显微镜可以协助提供高分辨率成像和高数据通量。
在本应用说明中,我们使用 CrestOptics X-light V3 共聚焦旋转盘 (CF) 对四种不同的 RNA 种类进行小鼠脑组织分析。凭借其无缝拼接能力和卓越的旋转盘模式灵活性,我们的系统特别适合用于绘制大脑细胞结构中单个 RNA 分子的高通量成像。
将旋转盘模式与应用程序相匹配
虽然大多数商业系统在旋转盘模式方面仅提供有限的选择,但旋转盘盒是 CrestOptics X-light V3 旋转盘 CF 中最常用的部件之一,它可以根据应用和成像要求自由选择最适合的旋转盘几何形状。换言之,我们的旋转盘可以定制不同的针孔大小和距离,以实现针孔串扰和三维切片能力之间的最佳平衡(关于如何将旋转盘模式与应用相匹配的更多信息,请访问我们的“技术”网页)。在本应用说明中,我们比较了采用两个不同模式的旋转盘在成像速度、共聚焦性和图像质量方面的采集情况(图 1A)。特别是,我们使用了带狭缝(HT 狭缝)的旋转盘,即包含连续螺旋而不是针孔(图 1A,左),专为需要高通量、高速度和低激励功率的样品而设计。在上下文中,我们使用了标准 (ST) 旋转盘(图 1A,右),包含直径为 50 um、间距为 250 um 的针孔,这代表了常规研究中广泛应用的亮度和共聚焦性之间的理想平衡。
A


B

图 1:高通量狭缝旋转盘(HT 狭缝)和标准 (ST) 旋转盘 (A);轴向分辨率数据,以 um 表示,在 200 nm 荧光珠上测得。
为了查看这两个旋转盘的使用如何影响显微镜相对于 WF 的轴向分辨率,我们采用 PSFj 软件分析了 200 nm 荧光珠的图像(图 1B),以获得有关轴向分辨率的信息。如图 1B 所示,与宽视场 (WF,880 nm) 相比,使用这两种模式可以大幅提高轴向分辨率(ST 为 600 nm,HT 狭缝为 720 nm)。与此同时,相对于 ST 旋转盘(CF 与 WF 之比 >3.1%),HT 狭缝旋转盘(CF 与 WF 之比 >13%)可以取得与系统通量之间的良好平衡,从而实现高速采集。根据样品的亮度和厚度,将旋转盘模式与样品相匹配至关重要,在接下来的段落中,我们将说明使用这两个旋转盘如何影响从样品中收集的光的水平,从而分析如何影响采集速度,同时不忽视共聚焦性和图像质量。
用于小鼠大脑切片无缝拼接的均匀照明
空间转录组学实验包括对大型复杂样本的连续多标记物成像,在这里我们展示了对小鼠大脑切片中单个 RNA 分子组织的研究。为此,对五个通道(用于细胞核可视化的 DAPI 和用于尽可能多的 RNA 种类的四个通道)执行了由 80 个 FOV 和 16 个 Z 平面(0.9 um 步长)组成的自动图像采集。通过 Plan Apo Lambda 20 倍空气物镜(数值孔径 0.75,工作距离 1)对全脑切片进行成像,使用 ST 和 HT 狭缝旋转盘进行相同类型的采集,比较采集时间和图像质量(图 2)。
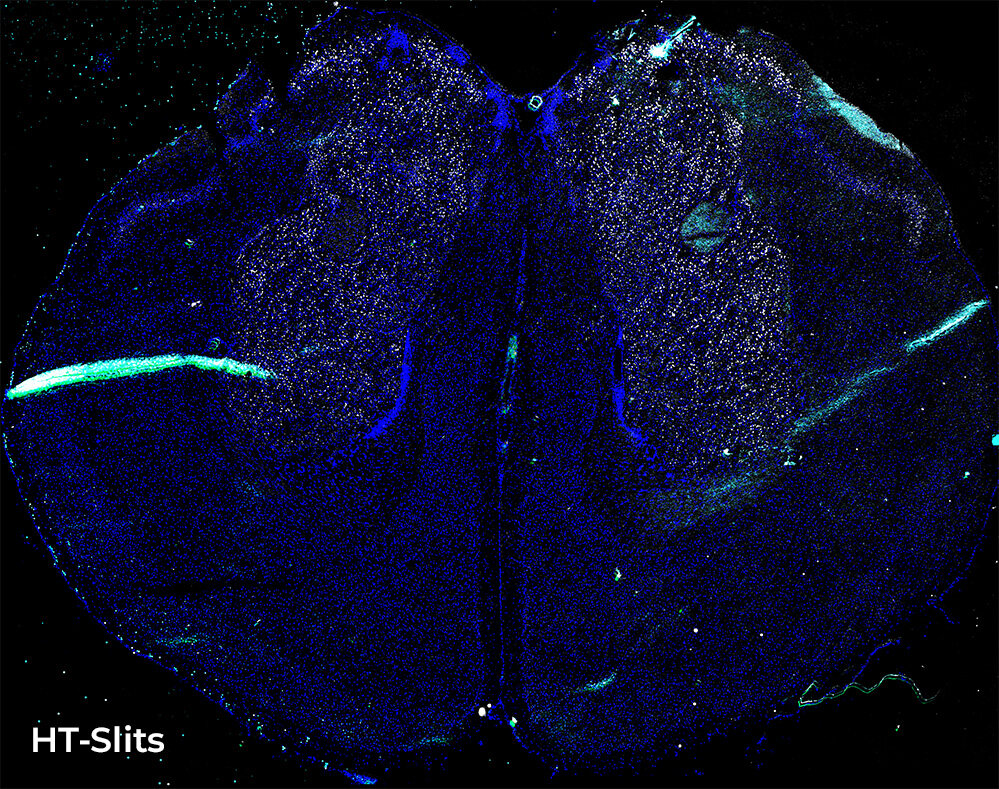

图 2:HT 狭缝旋转盘(上)与 ST 旋转盘(下)采集的比较。标有四种不同 RNA 种类(绿色、红色、青色和白色点)的小鼠大脑切片的大图像;单细胞核被染成蓝色。这些图像表示在堆栈(z 步长为 0.9 um 且 Z 范围为 18 um)中利用 CFI Plan Apo Lambda 20 倍空气物镜(数值孔径 0.75,工作距离 1)采集的小鼠脑切片的强度投影。比例尺:500 um。
在这两种情况下,切片拼接都没有出现伪影,这是因为系统的均匀照明。X-light V3 照明器基于微透镜技术,可以将来自多模光纤的高功率激光转化为均匀的方形准直光束,在整个 25 mm 的 FOV 上提供 90% 的均匀照明。这一独特的功能使 FOV 的外围得到适当的照明,从而获得可靠的数据且没有伪影,避免了任何后期处理的校正,并通过最大限度地减少拼贴重叠来提高速度。
然而,由于狭缝几何形状的高通量,使用 HT 狭缝旋转盘可大幅缩短采集时的曝光时间,与使用 ST 旋转盘进行的实验相比,节省了大量时间。事实上,只考虑采集时间和 Z 轴运动,使用 HT 狭缝旋转盘需要 23 分钟来采集整个样本(80 个尾部、18 个平面、5 个通道),而 ST 旋转盘则需 52 分钟。
这些数据表明,对于这种类型的应用,HT 狭缝旋转盘代表着通量和共聚焦性之间的适当平衡,与 ST 旋转盘相比,可以在短时间内获得非常复杂的图像,同时保持良好的图像质量。此外,如果我们考虑不使用压电台,甚至不使用 X-light V3 双摄像头配置来进行这些实验,那么在利用这些先进配置时,还可以进一步加快采集速度。
更高的放大倍率:共聚焦性和图像质量
一旦获得了整个组织区域的总体概况,我们就转向更高的放大倍率来观察细胞细节并研究单个细胞上的 RNA 点。
在图 3 中,报告了 WF、HT 狭缝和 ST 旋转盘 CF 采集之间的比较情况。特别是,这些图像表示了使用 CFI Plan Apo Lambda 60 倍油物镜(数值孔径 1.4,工作距离 0.13)采集的小鼠脑切片的 16 um Z 堆栈(0.2 um 步长)强度投影,可以很明显地看出,通过 CF 采集获得的分辨率实现了大幅提高。



图 3:WF(左)、CF-HT 狭缝(中)和 CF-ST 采集之间的比较。这些图像表示在堆栈(Z 步长为 0.2 um 且 Z 范围为 16 um)中利用 CFI Plan Apo Lambda 60 倍油物镜(数值孔径 1.4;工作距离 0.13)采集的小鼠脑切片的强度投影。比例尺:50 um。
在图 4 中,我们重点介绍了使用 CFI Plan Apo Lambda 60 倍油物镜在 16 um Z 范围内(0.2 um 步长)所采集图像的轴向分辨率,显示了 XY、XZ 和 YZ 正交视图(图 4A)和三维体积视图(图 4B)。为了更轻松地可视化,使光学切片更清晰,我们专注于两个单细胞和一个单一的 RNA 种类。WF 与使用 HT 狭缝和 ST 旋转盘进行采集间的比较清楚地表明,使用 CF 技术对这种小而密的点进行成像是多么重要。事实上,图 4 中的正交投影和三维视图显示,从 WF 切换到 CF 模式时的 Z 方向切片有明显的改善,使用这两个旋转盘采集的图像质量相似。
A
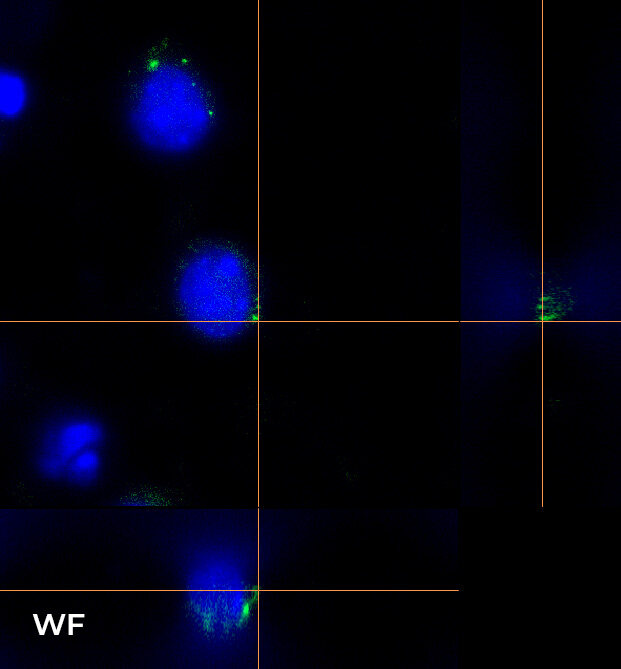
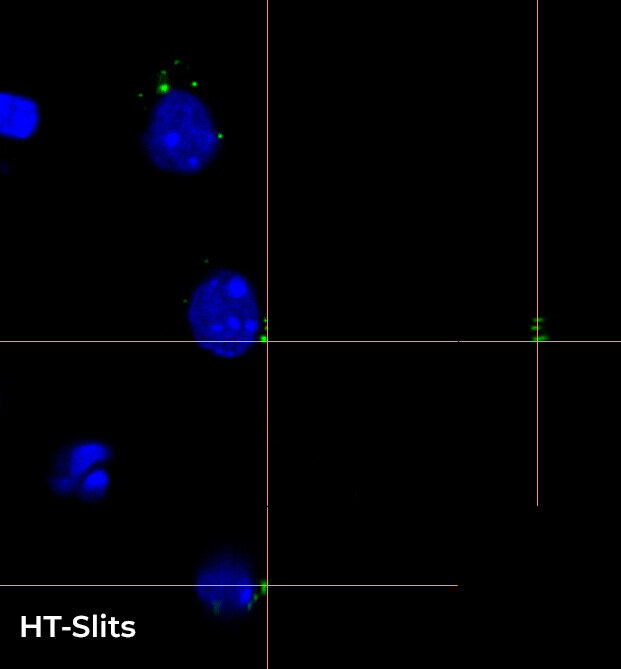
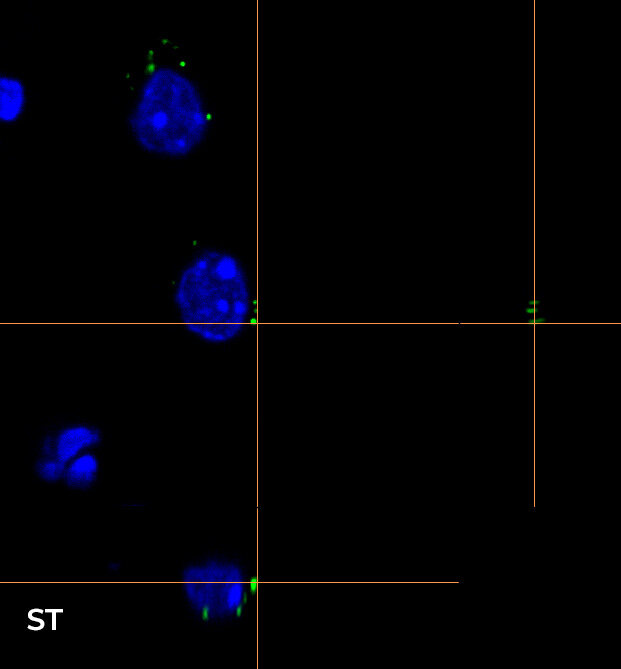
B
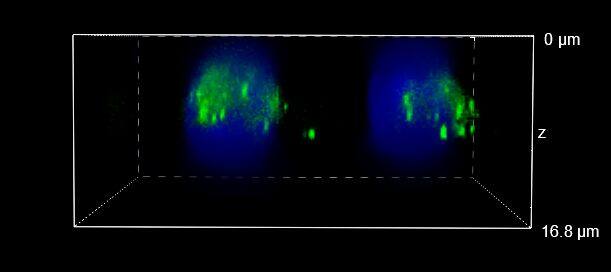
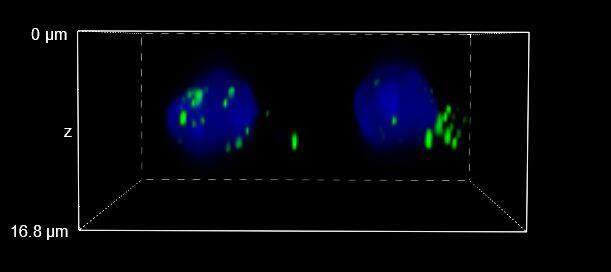
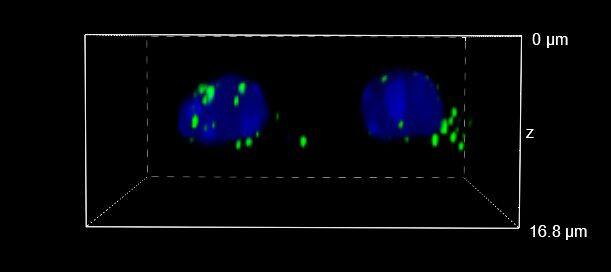
图 4:WF(左)、CF-HT 狭缝(中)和 CF-ST(右)采集之间的比较。XY、XZ 和 YZ 正交视图 (A) 和三维体积视图,16 um 厚度 (B),显示不同的光学切片和单细胞细节。这些图像是在堆栈(Z 步长为 0.2 um 且 Z 范围为 16.8 um)中利用 CFI Plan Apo Lambda 60 倍油物镜(数值孔径 1.4,工作距离 0.13)采集的。
图 5 显示了 WF 和 CF 图像之间的比较,聚焦于单个细胞和单个 Z 平面(样品内部 8 um)。正如这些图像所示,使用 CF 采集模式明显改善了 Z 方向切片;此外,与 3 个单一 RNA 点相关的强度分布图证明,使用 HT 狭缝旋转盘可以获得与 ST 旋转盘类似的图像质量。
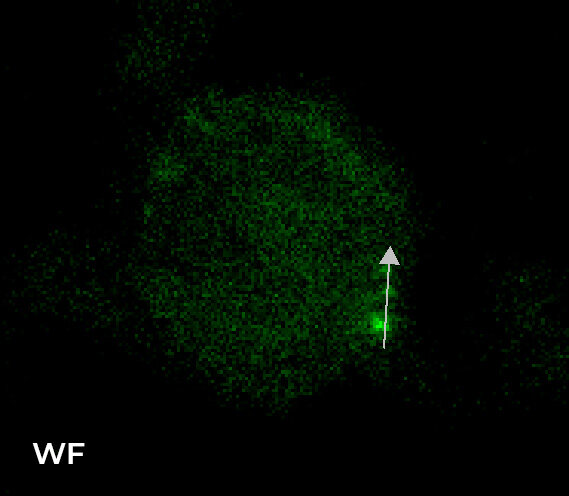
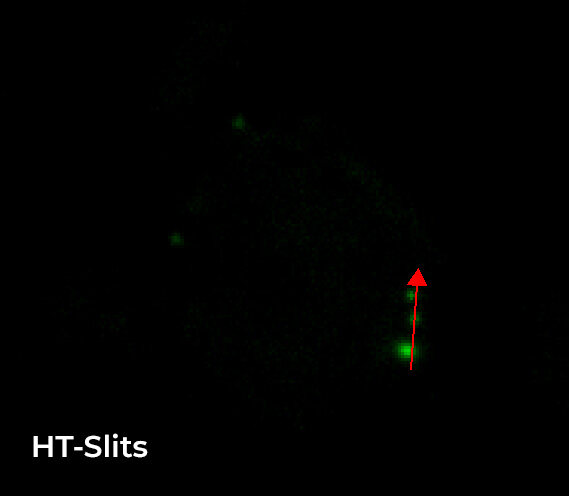
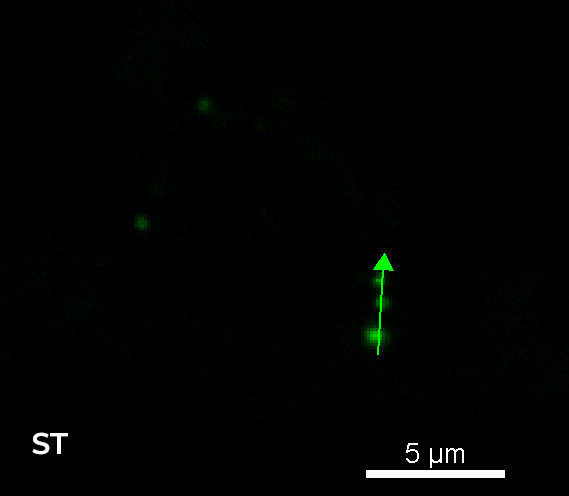

图 5:样品内 8 um 的单个细胞和单个 Z 平面的 WF(左上)、CF-HT 狭缝(中上)与 CF-ST(右上)采集之间的比较。比例尺:5 um。与三个 RNA 荧光点相关的强度分布比较(底部)。这些图像是在堆栈(Z 步长为 0.2 um 且 Z 范围为 16.8 um)中利用 CFI Plan Apo Lambda 60 倍空气物镜(数值孔径 1.4;工作距离 0.13)采集的。
最后,图 6 报告了 HT 狭缝(图 6A)和 ST(图 6B)的三维电影,再次显示了类似的分辨率。
A
B
图 6:CF-HT 狭缝(上)和 CF-ST(下)体积视图的三维电影对比。这些图像是在堆栈(Z 步长为 0.2 um 且 Z 范围为 16.8 um)中利用 CFI Plan Apo Lambda 60 倍空气物镜(数值孔径 1.4;工作距离 0.13)采集的。
总之,这些数据表明使用 CF 方法可以显著提高轴向分辨率。对比 HT 狭缝与 ST 旋转盘 60 倍采集的结果表明,使用 HT 狭缝旋转盘的采集也可以实现优秀的图像质量和共聚焦性。同时,狭缝模式可实现与系统通量的良好权衡,这意味着可以从样品中收集足够水平的光线,因此可以实现高速、高分辨率的采集。
总之,CrestOptics X-light V3 CF 旋转盘为空间生物学分析的高通量单细胞分辨率成像提供了一个强大的解决方案。由于在整个 25 mm 视场内的均匀照明,它可以对超大型样品的图像进行无缝拼接,从而收集可靠的数据而没有伪影,并提高速度。此外,CrestOptics 提供量身定制的解决方案,在选择最适合应用的旋转盘几何形状方面具有很大的灵活性,包括完全的旋转盘定制。HT 狭缝的几何形状是专为需要高速和低激励功率的暗淡标本和样品而设计的;这为空间转录组学和蛋白质组学研究提供了强大的解决方案,可以确保通量增加(与针孔相比通常是 3-4 倍),同时在没有过大厚度 (< 30 um) 的样品中保持良好的轴向分辨率。
关于如何将旋转盘模式与应用相匹配的更多信息,请访问我们的“技术”网页。
显微成像方法
本应用说明的所有采集均通过配备了 CrestOptics X-Light V3 旋转盘系统、Celesta 激光源 (Lumencore) 和具有 6.5 um 像素、29.4 mm 视场的 Kinetix sCMOS 相机 (Photometrics) 的 Nikon Eclipse Ti2 显微镜进行。图像通过 NIS-Elements 显微镜成像软件 (Nikon) 采集。
HT 狭缝旋转盘由连续螺旋组成,狭缝孔径为 50 um,间距为 380 um;ST 旋转盘包含 50 um 针孔直径,间距为 250 um。
图 1B 所示的轴向分辨率数据来自于使用 CFI Plan Apo Lambda 100 倍油物镜(数值孔径 1.45,工作距离 0.13)采集的 200 nm 荧光珠的分析结果。使用 PSFj 软件分析了图像。
图 2 表示 80 个 FOV 和 16 个 Z 平面的拼接图像,显示为强度投影。小鼠脑切片是在堆栈(Z 步长为 0.9 um)中利用 CFI Plan Apo Lambda 20 倍空气物镜(数值孔径 0.75,工作距离 1)采集的。比例尺:500 um。
图 3、4、5 和 6 显示了在堆栈(Z 步长为 0.2 um 且 Z 范围为 16.8 um)中利用 CFI Plan Apo Lambda 60 倍油物镜(数值孔径 1.4;工作距离 0.13)采集的小鼠脑切片的不同可视化。
本应用说明中使用的样品是小鼠大脑切片,标记有 4 种不同的 RNA 种类和用于细胞核可视化的 DAPI。此样品由罗马 EMBL 显微镜部负责人 Alvaro Crevenna 博士友情提供。